
Hoever staan we met ‘de meest complexe kankertherapie aller tijden’?

Wetenschappers proberen steeds meer gebruik te maken van lichaamseigen cellen om het gevecht tegen ziektes zoals kanker te winnen.
Een jaar geleden verscheen in het wetenschappelijke topvakblad Nature een artikel over een nieuwe antikankerbehandeling, die toen bestempeld werd als ‘de meest complexe therapie aller tijden’. Het ging om de creatie van een legertje cellen tegen kankergezwellen. De cellen waren T-cellen uit onze eigen afweer die zo werden bijgestuurd dat ze kankercellen makkelijker als vijand herkennen. De bedoeling was dat ze actief kankergezwellen zouden opsporen en uitschakelen.
De strategie is bekend geworden als CAR-T-celtherapie, waarbij CAR staat voor chimere antigeenreceptor. De term verwijst naar de techniek waarmee wetenschappers T-cellen programmeren om kankers en andere probleemcellen aan te vallen. Ze worden genetisch op zo’n manier bijgewerkt dat ze een extra ankerpunt op hun buitenkant (een receptor) krijgen, die erop gericht is een uniek eiwit (een antigeen) op het oppervlak van kankercellen te herkennen. De hoop is dat T-afweercellen zich dan zodanig massaal aan kankercellen gaan hangen dat ze in staat zijn om een tumor te liquideren.
Maar de beschrijving van de procedure leest als een wetenschappelijke lijdensweg. De onderzoekers probeerden hun aanpak uit op zestien patiënten met borst- of darmkanker. Voor elke patiënt zochten ze naar specifieke veranderingen in eiwitten op de wand van de kankercellen – elke kanker heeft zijn eigen mutaties. Vervolgens werd artificiële intelligentie (AI) ingeschakeld om na te gaan welke mutaties de grootste kans hadden om als geschikte schietschijf voor T-cellen te fungeren. Ook dat moest voor elke patiënt afzonderlijk gebeuren.
Bij sommigen draait de afweer altijd op een lager pitje, waardoor ze makkelijker ziek worden.
Nadat de schietschijven (de antigenen) geïdentificeerd waren, moesten de nieuwe ankers voor de T-cellen ontwikkeld worden. Zodra die horde genomen was, moesten er T-cellen uit het lichaam van de patiënten gehaald worden. De cellen werden in laboratoria genetisch bewerkt om de geselecteerde ankers te kunnen produceren. Daarvoor werd de ook al nieuwe CRISPR/Cas9-technologie voor genetisch design ingeschakeld, die haar ontdekkers in 2020 de Nobelprijs voor de Geneeskunde opleverde. Uiteindelijk werden de bijgewerkte T-cellen opnieuw in het lichaam van de patiënten ingespoten in de hoop dat ze genezing zouden bevorderen.
Het riool van een gezwel
Voor sommige patiënten liep de duur van de behandeling op tot meer dan een jaar. Bij vijf van de zestien werd een significante verbetering vastgesteld, maar volgens de betrokken onderzoekers was het belangrijker dat slechts twee patiënten ernstige neveneffecten van de behandeling ondervonden. Omdat het pionierswerk betrof, werden er lage dosissen CAR-T-cellen ingespoten om neveneffecten te vermijden. Er moet nog gezocht worden naar de dosis met de beste balans tussen gewenste effecten en ongewenste neveneffecten. Een behandeling is vooralsnog ook peperduur en kan alleen in gespecialiseerde ziekenhuizen worden uitgevoerd.
CAR-T-celtherapie werkt beter voor bloed- en lymfekankers, zoals leukemie, dan voor vaste kankergezwellen, hoewel niet alle patiënten er evenveel voordeel uit puren. Maar de aanpak is veelbelovend genoeg om nu al geregeld te worden toegepast. Het verschil met solide tumoren is dat bloedkankercellen veel uniformere schietschijven op hun buitenkant hebben, zodat het makkelijker is om er T-cellen tegen te programmeren. Vaste tumoren zijn genetisch veel meer variabel, wat de uitdaging groter maakt. Bovendien bevinden ze zich in een lichaamscontext die wetenschappers soms smalend ‘een riool’ noemen, omdat het er vol cellulaire afval- en afbreekproducten zit. Daardoor kan het voor T-cellen moeilijker zijn om bij tumoren te komen.
De uitdagingen zijn dus groot, maar de vooruitzichten voor succes worden steeds beter. Vooral omdat de technologie waarschijnlijk sneller nuttig zal zijn voor de behandeling van andere aandoeningen dan kanker. Astma, diabetes en multiple sclerose (MS) staan op het lijstje, naast hartaandoeningen en virale ziektes zoals aids.
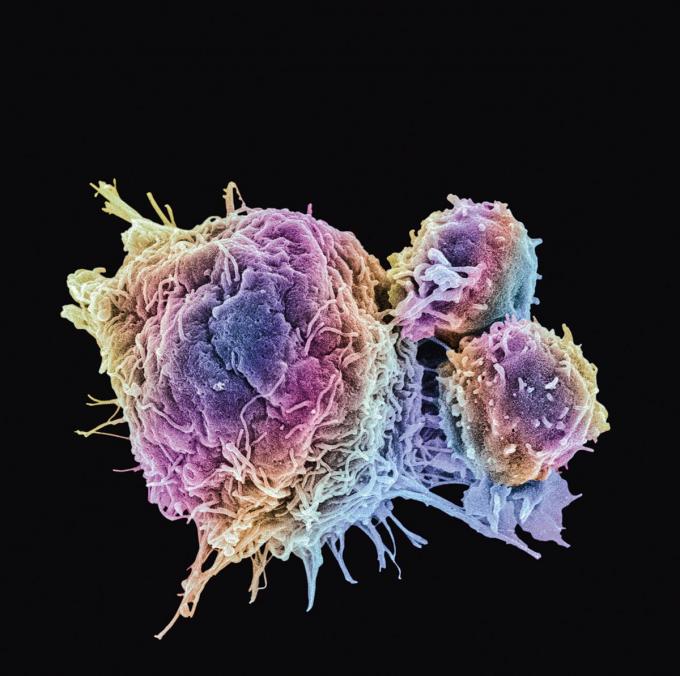
Het principe achter het concept is briljant. In plaats van al dan niet lichaamsvreemde chemische stoffen als geneesmiddel in te zetten, versterk je de lichaamseigen afweer van een patiënt. Dat zou nevenwerkingen moeten beperken. Onze afweer is een echt wonder van de natuur. Als je leest hoe complex hij in elkaar zit, kun je niet anders dan je afvragen hoe het komt dat hij niet frequenter in de fout gaat. Eigenlijk is het een mirakel dat de meesten van ons het grootste deel van hun leven in relatief goede gezondheid doorbrengen. En als het toch eens misgaat, heeft het tegenwoordig niet zelden te maken met wat we gemakshalve een ongezonde levensstijl zijn gaan noemen, grotendeels vermijdbaar dus.
Ons leger
Het is niet verwonderlijk dat onze afweer courant met een ‘leger’ vergeleken wordt. Hij is georganiseerd rond ‘divisies’ die elk hun eigen taak hebben, maar toch moeten samenwerken. Zo is er een aangeboren eerstelijnscomponent, met als voornaamste vertegenwoordigers macrofagen: witte bloedcellen die overal rondzwerven en potentieel vijandige vreemde indringers of mogelijk toxische afvalproducten van bijvoorbeeld verouderde lichaamscellen opzwelgen en afbreken. Ze lossen daarbij chemische stoffen die de tweede lijn van de afweer, de adaptieve of aanpassingsvaardige, mobiliseren om specifieke doelwitten te viseren.
B-cellen behoren tot de tweedelijnssoldaten. Zij produceren antistoffen tegen een bedreiging, zodat een lichaam een geheugen tegen een probleem vormt – het immunologische geheugen moet het mogelijk maken dat een lichaam sneller en efficiënter in actie komt tegen een vijand waar het al eens mee te maken had.
Voorts zijn er T-cellen, die in verschillende vormen voorkomen, zoals killer-T’s die aanvallers of fout evoluerende cellen moeten uitschakelen, maar ook helper-T’s die de communicatie met andere afweercellen verzorgen en regulerende-T’s die een aanval afblazen als hij succesvol is geweest. In de meeste gevallen werkt het uitstekend.
Maar net als in mensenlegers kan er van alles mislopen, onder meer als gevolg van gebrekkige samenwerking tussen divisies. Bij sommige mensen draait de afweer permanent op een laag niveau, zodat ze veel makkelijker ziek worden. Een afweer kan ook overactief worden en een stormloop op het eigen lichaam uitvoeren, wat zich manifesteert als een zogenaamde cytokinestorm. Zoiets kostte heel wat coronapatiënten het leven: het was niet het virus dat hen doodde, wel hun door de virale besmetting compleet losgeslagen eigen afweer.
Soms keert de afweer zich tegen andere lichaamscellen, met desastreuze gevolgen. Auto-immuunziekten zoals de darmziekte van Crohn en sommige vormen van reuma zijn er een gevolg van. Ook allergieën kunnen een gevolg zijn van een slecht werkende afweer. Een van de rare kronkels in het CAR-T-celonderzoek is dat de technologie gebruikt zou kunnen worden om buiten de rangen opererende afweercellen uit te schakelen en zo auto-immuunziektes te behandelen.
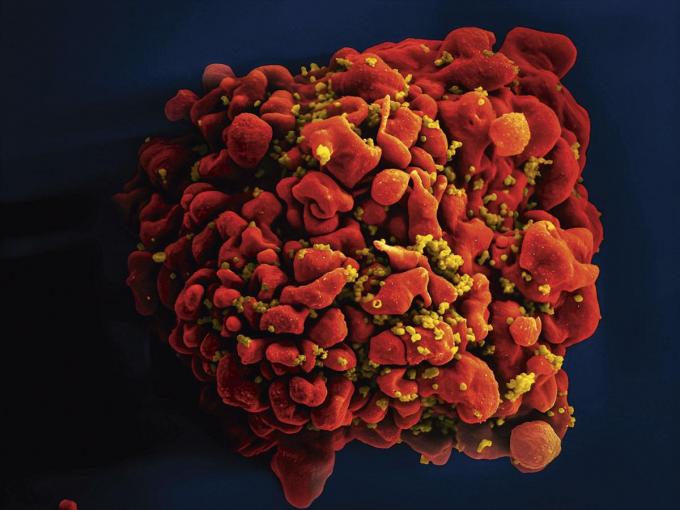
Meestal is je afweer erg discreet. Je bent je er zelden van bewust dat hij er is en dat hij constant optreedt tegen bedreigingen. Anders zouden we veel meer ziek worden en minder lang leven. Wat niet wil zeggen dat we ons moeten neerleggen bij situaties waarin het fout loopt. Het inzicht dat we onze zo al fantastische afweer kunnen helpen, is een belangrijke medische doorbraak.
Bizarre problemen
Makkelijk wordt het niet om van de technologie een mainstream praktijk te maken. Er zijn talloze aanpassingen nodig om ze te perfectioneren. De ontwikkeling van de beste anker (receptor) voor de T-cellen wordt cruciaal. Momenteel bestaat hij meestal uit een combinatie van drie eiwitten: één voor de detectie van de antigenen op bijvoorbeeld kankercellen, en twee voor het versterken van de eigen activiteit van een T-cel in het geval van een alarm.
Wetenschappers klampen zich vast aan de hoop dat ze ook voor solide kankergezwellen antigenen zullen vinden die zo algemeen zijn dat ze niet telkens opnieuw, voor elke patiënt afzonderlijk, hoeven te onderzoeken wat de beste schietschijven zijn.
Er doen zich ook bizarre problemen voor. Zo hebben T-cellen een off-switch om te vermijden dat ze funeste effecten op gezonde cellen zouden hebben. Onderzoekers hebben vastgesteld dat kankercellen weerstand tegen onze soldaten kunnen ontwikkelen, onder meer door zelf T-cellen te inactiveren door in te grijpen op hun off-switch. Kanker geeft zich niet zomeer gewonnen.
Verschillende lijnen van basisonderzoek worden geëxploreerd om CAR-T-celtherapie efficiënter te maken. Het blad New Scientist besprak werk van Nederlandse vorsers die hun eigen versie van AI maakten: Artificiële Immunologische Intelligentie (AII). De basis daarvan is de vaststelling dat onze afweer in staat is om te leren uit ervaring en zijn werking bij te sturen. Net zoals hersenintelligentie, die steunt op een voortdurend veranderend netwerk van verbindingen tussen hersencellen, steunt AII op evoluerende interacties tussen de verschillende divisies van het afweerleger.
In een computer kunnen wetenschappers een digitale versie van een afweersysteem creëren en bestuderen. Een van de sleutelvragen is hoe T-cellen leren welke cellen ze moeten aanvallen en welke ze met rust moeten laten. Dat is een kwestie van welke eiwitten op cellen al dan niet als schietschijf gelabeld raken. Omdat er zo massaal veel potentiële schietschijven in een lichaam aanwezig zijn, is het onmogelijk om jonge en onervaren T-cellen actief te leren wat ze moeten aanvallen en wat niet. Ze moeten zelf zien uit te vissen wat ze moeten doen. Inzicht krijgen in hoe ze het doen, zou T-celtherapie beduidend specifieker en dus efficiënter kunnen maken.
Onze afweer is als een leger. De divisies hebben eigen taken, maar moeten ook samenwerken.
Het vakblad Science presenteerde enkele weken geleden een nieuwe mogelijke route om de kwestie te optimaliseren. Ze steunt op het inschakelen van een ander aspect uit ons leven met twee kanten, een lichte en een donkere: bacteriën. De achterliggende gedachte is dat veel bacteriën makkelijker in een tumormilieu kunnen binnendringen dan T-cellen. Sommige bacteriën zijn zelfs aangepast aan een leven in tumoren. Bovendien kunnen bacteriën genetisch zo worden bijgestuurd dat ze in een gezwel specifieke eiwitten loslaten, die vervolgens T-cellen kunnen mobiliseren, zeker als die met CAR-therapie zo zijn bewerkt dat ze sterk reageren op de bacteriële lokkers. De bacteriën fungeren dan als bioreactoren die aan de lopende band stoffen produceren, waarmee kankercellen kunnen worden aangevallen. Initiële tests lijken uit te wijzen dat het kan werken.
Perfecte postbode
Misschien wel de meest veelbelovende optie voor een substantiële verbetering op korte (of middellange) termijn is een molecule die de laatste tijd geregeld het nieuws haalt – zeker sinds de onderzoekers die haar als eersten met succes in een medische behandeling inzetten de laatste Nobelprijs voor de Geneeskunde kregen. Het gaat om mRNA, dat de basis was van de vaccins die ons een klinkende overwinning tegen het coronavirus bezorgden. In ons lichaam verzorgt mRNA de overschrijving van de genetische eigenschappen uit het DNA in eiwitten.
Het recente overzichtsartikel in Nature, dat als bijtitel ‘de evolutie van een levend geneesmiddel’ had, belicht de mogelijkheden van mRNA binnen CAR-T-celtherapie. Het grootste voordeel zou zijn dat de T-cellen niet langer uit het lichaam van een patiënt hoeven te worden gehaald om ze in een laboratorium genetisch zo bij te sturen dat ze ankers voor specifieke schietschijven krijgen. Met mRNA zouden de T-cellen in het lichaam zelf aangepast kunnen worden. Er kunnen unieke mRNA-moleculen ingespoten worden, die de T-cellen gaan zoeken en er de nodige informatie voor schietschijven van bijvoorbeeld kankercellen in brengen. De ‘m’ van mRNA staat niet voor niets voor messenger: boodschapper. De molecule lijkt de perfecte postbode voor onze geneeskunde te worden.