Wat als de motor van je medicijnpomp blokkeert?

In België zijn bijna 6000 medicijnpompen van het merk SynchroMed II verdeeld. De pomp kampte jarenlang met problemen. In 2015 sloot fabrikant Medtronic zelfs een schikking af met de Amerikaanse Inspectie van voedings- en geneesmiddelen (FDA).
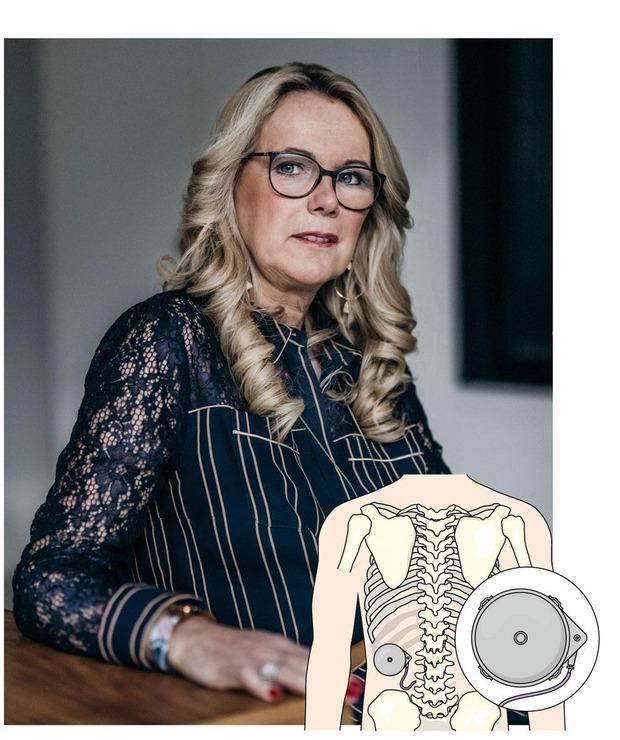
‘Zeven jaar lang zat ik in een rolstoel. Maar sinds ik de SynchroMed II-pomp heb, kan ik weer op hoge hakjes rondstappen.’ Voor Annick Luytens (51) uit Schoten heeft de medicijnpomp haar leven veranderd. In 2007 werden bij Luytens spasmeproblemen vastgesteld. Ze kon niet meer gaan werken, had voortdurend pijn en belandde in een rolstoel. ‘Ik moest heel veel medicijnen innemen en had last van tal van bijwerkingen. Mijn hart klopte te snel. Ik kon soms niet spreken. Ik had geen normaal leven meer. Na verschillende onderzoeken bleek dat ik in aanmerking kwam voor de medicijnpomp.’ Die werd in 2017 geïmplanteerd. ‘Het is écht dag en nacht verschil. De eerste drie maanden verliepen moeilijk, maar intussen kan ik eenvoudige huishoudelijke taken zelf doen. Samen met mijn man ga ik fietsen op een tandem. Zelfs autorijden lukt weer voor korte afstanden. Dankzij SynchroMed heb ik weer een draaglijk leven. De pomp onderdrukt de spasmes goed. Ik ben ook altijd in mijzelf blijven geloven.’
De productie en de distributie van SynchroMed II werden aan strikte voorwaarden onderworpen.
Luytens kreeg de pomp, een ronde metalen doos gevuld met de spierontspanner baclofen, in de buik geplaatst. Een dun, flexibel siliconenslangetje verbindt de pomp met de vloeistof rond haar ruggenmerg, waar de medicatie wordt afgeleverd. Om de drie maanden laat ze de pomp bijvullen met nieuwe medicatie. Haar arts kan de dosering bijstellen wanneer dat nodig is. De pomp werkt dankzij een inwendige batterij, die 5 tot 7 jaar moet meegaan.
Niet alleen patiënten met spasmen hebben baat bij de SynchroMed II. De pomp helpt ook bij de behandeling van chronische pijn. Dan wordt ze gevuld met morfine. ‘De pomp wordt voornamelijk gebruikt bij patiënten bij wie de andere toedieningsmethodes – via de mond of door de huid – uitgeput zijn door te zware bijwerkingen. Of omdat de dosissen niet verder verhoogd kunnen worden via die toedieningsmethodes’, zegt het geneesmiddelenagentschap FAGG. ‘Er zijn voor deze patiënten amper of geen alternatieven voor SynchroMed II op de markt. De pomp biedt een ontegensprekelijk voordeel in levenskwaliteit voor deze groep van patiënten.’
Sinds 2004 is de pomp in Europa op de markt. Volgens het FAGG zijn intussen 5965 stuks verdeeld in België. Het RIZIV betaalt de prijs van de pomp (9570,81 euro) volledig terug aan de patiënt.
Tevreden artsen
Knack polste bij drie Belgische specialisten naar hun ervaring met SynchroMed II: neurochirurg Tom Theys (UZ Leuven), neurochirurg Maarten Moens (UZ Brussel) en anesthesist Jean-Pierre Van Buyten (AZ Nikolaas). Alle drie zijn ze heel erg te spreken over de resultaten die ze met de medicatiepomp boeken.
‘Ik gebruik SynchroMed II al meer dan vijftien jaar, en ik stel een nauwgezette opvolging vast bij de fabrikant om alles uit te pluizen wanneer zich een probleem voordoet – ook wanneer dat veroorzaakt wordt door een verkeerde handeling van de patiënt. Ze laten niets op zijn beloop’, zegt Maarten Moens. Een zwaar incident heeft hij zelf nog nooit meegemaakt met SynchroMed II. ‘Als er iets gebeurt, is het doorgaans niet door de pomp zelf maar door de dosering van de medicatie. Een pomp moet af en toe bijgevuld worden. Wanneer een patiënt daarvoor niet tijdig naar het ziekenhuis komt, krijgt hij ontwenningsverschijnselen. Die kunnen zware gevolgen hebben.’
Eén keer moest Moens een pomp vroegtijdig vervangen, bij een patiënt met ontwenningsverschijnselen. ‘De pomp viel stil, waardoor de patiënt zijn medicatie niet kreeg. De patiënt is binnengekomen via de spoed, maar stelt het nu goed. De oorzaak was het gebruik van aangepaste medicatie. De pomp is eigenlijk gemaakt voor de toediening van morfine en baclofen, maar veel artsen passen de medicatie aan om ze zo goed mogelijk af te stemmen op wat de patiënt nodig heeft. Dan kan de pomp minder accuraat zijn. Ze kan dan sneller verslijten, of het kan een impact hebben op de werking van bepaalde onderdelen. De fabrikant past de pomp echter constant aan, zodat patiënten met “off label”-medicatie toch een grotere kans op accuraatheid hebben.’
Jean-Pierre Van Buyten vult aan dat ‘off label’-gebruik te maken heeft met de therapeutische vrijheid van de arts. ‘Wereldwijd is het in verschillende domeinen een courante praktijk. Het draagt bij tot de evolutie van de geneeskunde. In 2012 heeft een groep van internationale experts nog een artikel gepubliceerd waaruit een wereldwijde consensus blijkt.’
In het UZ Leuven plaatsten specialisten het voorbije jaar een zeventigtal SynchroMed II-pompen. Tom Theys: ‘Wij hebben er heel goede ervaringen mee. Natuurlijk gaat ieder medisch hulpmiddel gepaard met bepaalde risico’s. En in dit geval, als je medicatie rechtstreeks in het ruggenmergvocht aflevert, kunnen de complicaties veel belangrijker zijn dan wanneer je pilletjes gebruikt. Als zo’n katheter verstopt of de pomp wordt gestopt, krijgt de patiënt plots géén baclofen meer. Dan gaat hij eventueel ontwennen. Daarbij kunnen zeer belangrijke symptomen ontstaan, en kan de patiënt op intensieve zorg belanden, en theoretisch zelfs overlijden. Maar omdat wij zo voorzichtig zijn, denk ik dat dit scenario zich nooit of bijna nooit voordoet.’

Motorblokkering
Sinds de pomp op de Europese markt is, moest fabrikant Medtronic herhaaldelijk maatregelen treffen. Tussen 2013 en 2017 ontving het FAGG over SynchroMed II tien zogenaamde Field Safety Corrective Actions (‘corrigerende maatregelen in verband met de veiligheid op het terrein’). Daarin kaartte de fabrikant verschillende soorten problemen aan: over- of onderdosering, kortsluiting, motorblokkering, verstopping van de vulsets, het niet functioneren van het akoestische alarm, en verminderde batterijprestaties.
Het FAGG ontving in dezelfde periode ook 75 incidentrapporten over de pomp. Dat aantal zegt an sich niets over de veiligheid. Vraag is telkens wat de oorzaak is van het incident. Daarom vroegen we via de Wet op de openbaarheid van bestuur bij het FAGG alle incidentrapporten over Synchromed II op uit de periode 2016-2018. We ontvingen 47 rapporten, die betrekking hebben op incidenten in 23 Belgische ziekenhuizen. In 35 van de 47 rapporten is sprake van een motorblokkering. In de rapporten spreekt Medtronic van 465 soortgelijke gevallen wereldwijd. In 23 van de 47 rapporten is sprake van het gebruik van niet-goedgekeurde medicijnen als oorzaak of mogelijke oorzaak van het incident.
In 2013 bezocht de Amerikaanse Inspectie van voedings- en geneesmiddelen (FDA) de productiefaciliteiten van de neuro-afdeling van Medtronic. De inspecteurs stelden verscheidene problemen vast met betrekking tot het kwaliteitssysteem. Heel wat problemen waren rechtstreeks gelinkt aan de productie van SynchroMed II. Twee jaar later ondertekenden Medtronic en de FDA een schikking: de productie en de distributie van SynchroMed II werden aan strikte voorwaarden onderworpen. Ze waren enkel toegestaan voor patiënten die reeds een pomp geïmplanteerd hadden en die vervangen moest worden, en voor nieuwe patiënten waarbij sprake was van een medische noodzaak. Medtronic moest een plan implementeren om wijzigingen aan de pomp door te voeren. In september 2017 hief de FDA de productie- en distributiebeperkingen op.
‘We hebben met de FDA samengewerkt om die problemen aan te pakken’, reageert Medtronic. ‘We hebben procedures en processen opgezet om zulke situaties in de toekomst te voorkomen. We blijven SynchroMed fabriceren en vermarkten met alle nodige regelgevende goedkeuringen. Met meer dan 290.000 SynchroMed II-pompen wereldwijd geïmplanteerd, kan Medtronic de potentiële verbeteringsmogelijkheden identificeren. Medtronic bewaakt voortdurend de prestaties van het product om de ervaring en de veiligheid van de patiënt te beoordelen. We leveren veilige, effectieve en levensverbeterende therapie aan patiënten wereldwijd.’
De Implant Files
Fout opgemerkt of meer nieuws? Meld het hier