Klinische studies: feiten en cijfers
Jaarlijks nemen ruim 170.000 Belgen deel aan klinische studies.
De proefpersonen in klinische studies – van gezonde personen tot patiënten – zijn altijd vrijwilligers. Jaarlijks nemen ruim 170.000 Belgen aan zulke studies deel. In 2016 liepen er 1.399 klinische studies in ons land en werden er 506 aanvragen voor nieuwe klinische studies ingediend. Daarmee telde België in 2016 na Denemarken het grootste aantal klinische studies per inwoner in Europa. (bron: Pharma.be en FAGG)
Zo’n 80 % van de klinische studies in ons land gaat uit van de farmaceutische industrie, die voornamelijk nieuwe geneesmiddelen test. De ontwikkelingskosten van een nieuw geneesmiddel bedragen rond 1,5 miljard euro en zijn voor niet-commerciële organisaties zelden een haalbare kaart. Toch voeren ook ziekenhuizen en universiteiten eigen klinische studies uit, waarin ze bijvoorbeeld testen of ze de kwaliteit van een bestaande behandelingsmethode kunnen verbeteren. Uiteraard werken veel ziekenhuizen ook mee aan de klinische geneesmiddelenstudies van farmabedrijven. Ziekenhuizen hebben nu eenmaal de patiënten in huis.
Gefaseerd testen bij vrijwilligers
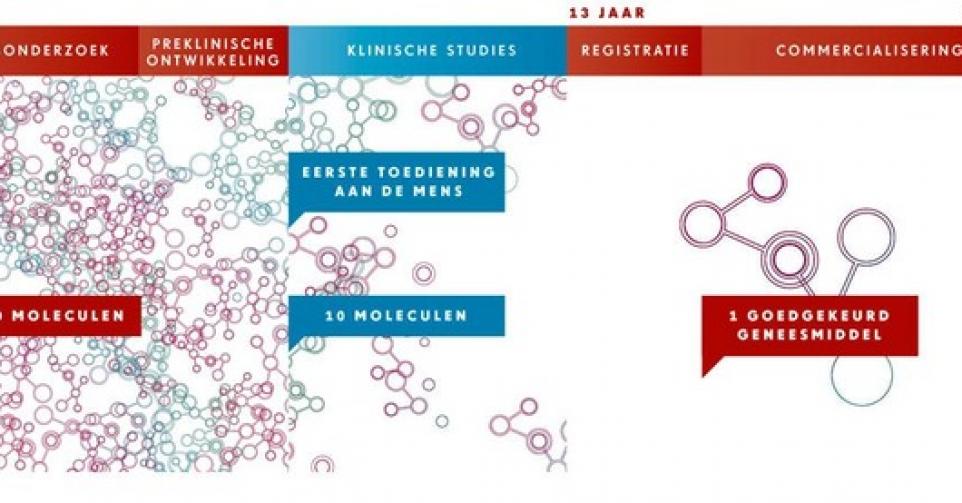
Binnen de geneesmiddelenontwikkeling zijn klinische studies een verplicht onderdeel van het traject dat een kandidaat-geneesmiddel succesvol moet doorlopen om in aanmerking te komen voor registratie. Die studies verlopen in 4 fasen.
Het kandidaat-geneesmiddel, ook studiegeneesmiddel genoemd, wordt in fase 1 bij enkele tientallen gezonde vrijwilligers getest. De dosering wordt geleidelijk opgevoerd, tot duidelijk waarneembare biologische effecten optreden. Er wordt nagegaan hoe goed het studiegeneesmiddel wordt verdragen en hoe ons lichaam het opneemt, verdeelt, afbreekt en uitscheidt.
Potentiële therapeutische effecten kunnen uiteraard maar worden nagegaan bij patiënten. Naar het einde van fase 1 toe probeert men daar bij een handvol patiënten vaak al enig idee over te krijgen. Om vervolgens de werkzaamheid en de veiligheid van het studiegeneesmiddel uitvoerig te onderzoeken in fase 2 van het klinisch onderzoek, bij enkele honderden patiënten, en te bevestigen in fase 3, bij enkele duizenden patiënten.
Na een succesvolle fase 3, zo’n 12 tot 14 jaar na de ontdekking van de nieuwe molecule, worden de resultaten voorgelegd aan de registratieautoriteiten. Als zij groen licht geven, wordt bij de overheid een prijs en terugbetaling aangevraagd, waarna het geneesmiddel op de markt verschijnt. Na de marktintroductie worden de werkzaamheid en de veiligheid van het geneesmiddel in fase 4, op wereldschaal én op lange termijn, opgevolgd.
Dossier: deelnemen aan klinische studies
Fout opgemerkt of meer nieuws? Meld het hier




